Últimas Notícias
Butantã e Sinovac apresentam à Anvisa primeiros dados de vacina contra a Covid-19
Governo paulista tem compromisso de compra logo que testes comprovem eficácia e segurança da imunização chinesa
Vacina da chinesa Sinovac e do Instituto Butantã, com acordo de fabricação em São Paulo, é a segunda a entregar pacotes de dados para a Anvisa, responsável pelo registro e vigilância de fármacos no Pa
A Anvisa recebeu para análise, nesta sexta-feira (2/10), o primeiro pacote de dados referente à vacina contra Covid-19 desenvolvida pela Sinovac em parceria com o Instituto Butantã. A revisão desses dados é possível devido à implantação do procedimento de submissão contínua, que permite verificar os documentos à medida que se tornam disponíveis. Isso não significa, porém, um pedido oficial de registro da vacina.
Na quinta-feira (1º/10), a Agência recebeu, também em procedimento de submissão contínua, o primeiro pacote de dados da vacina desenvolvida pela AstraZeneca em colaboração com a Universidade de Oxford. Agora, portanto, a Agência já dispõe dos primeiros dados de duas vacinas. Importante ressaltar que não existe, neste momento, nenhuma conclusão sobre a qualidade, a segurança e a eficácia de nenhuma das duas vacinas, que continuam cumprindo a terceira etapa de testes. Ouça a explicação sobre o processo de análise e farmacovigilância que cerca vacinas, no depoimento de Gustavo Mendes, gerente geral de medicamentos e produtos biológicos da Anvisa, no podcast do Eu, Rio! (eurio.com.br)
A submissão contínua é um procedimento diferenciado para tornar mais rápida a análise de dados referentes às vacinas contra Covid-19 a serem registradas no país. A partir da adoção desse procedimento, não é preciso aguardar a disponibilização de todos os dados e documentos técnicos, bem como o preenchimento dos requerimentos regulatórios, para iniciar a submissão do registro junto à Anvisa. Mas vários passos, obrigatoriamente, ainda precisam ser dados.
A Agência reforça seu compromisso em disponibilizar, de forma segura, o acesso a vacinas da forma mais ágil possível no contexto de emergências em saúde pública, como estamos passando neste momento devido à pandemia do novo coronavírus. Quatro vacinas foram autorizadas pela Anvisa para desenvolvimento no país, após avaliação das condições de resposta às necessidades regulatórias, no caso de eventual registro no futuro, e à segurança dos participantes envolvidos. Vale ressaltar que, quando o desenvolvimento clínico de uma vacina é inteiramente conduzido no exterior, não há a obrigatoriedade da anuência prévia, por parte da Anvisa, aos estudos clínicos. Porém, o registro permanece sendo necessário.
No quadro apresentado abaixo, é possível observar que algumas das vacinas preveem transferência de tecnologia. Essa questão é importante para que a produção da vacina seja completamente internalizada e se torne nacional. Ou seja, a transferência de tecnologia está diretamente relacionada à autossuficiência do país na produção da vacina.
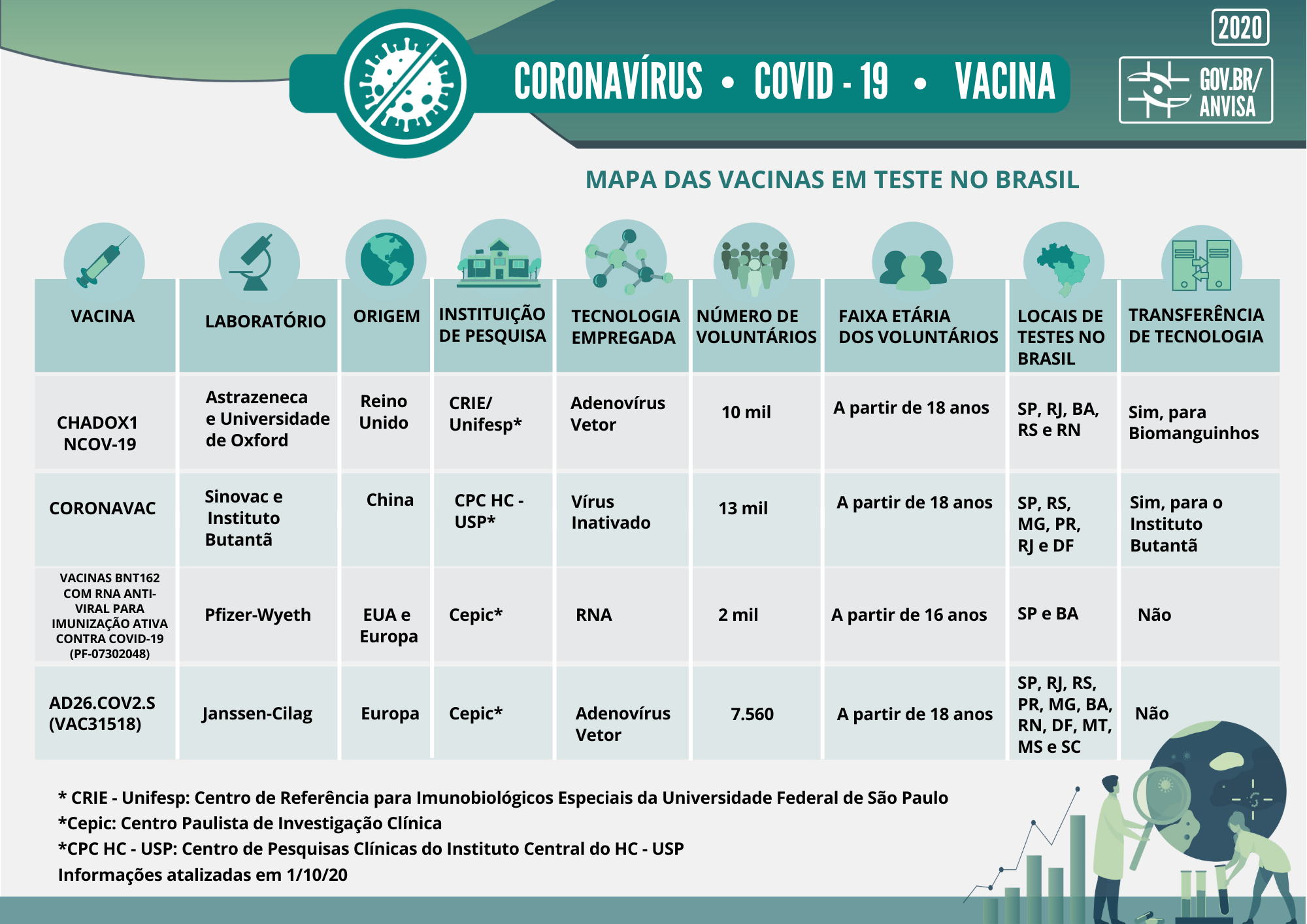
Os pesquisadores estão recorrendo a várias tecnologias, algumas delas nunca usadas anteriormente em vacinas. Todas as vacinas, porém, expõem o indivíduo a um antígeno (substância que, uma vez introduzida no organismo, é capaz de deflagrar a produção de anticorpo específico). Embora esse antígeno não cause a doença, ele provoca uma resposta imune que pode bloquear ou matar o vírus quando o indivíduo é exposto a ele.
A anuência dos estudos clínicos realizados no Brasil está condicionada a quatro aspectos principais: (1) dados de segurança; (2) delineamento do estudo proposto; (3) dados de produção e controle de qualidade; e (4) boas práticas clínicas. Os dados de segurança já devem ter sido gerados em estudos anteriores, para garantir a segurança da respectiva vacina, e são checados pela equipe responsável pelas análises. O delineamento do estudo avalia a robustez científica (quantidade de voluntários e faixa etária a ser estudada, abordagem estatística, parâmetros que garantam resultados de eficácia e segurança, entre outros).
Os dados de produção e controle de qualidade visam identificar as características de qualidade da vacina em estudo, por exemplo, as condições técnico-operacionais do local de fabricação. Já as boas práticas clínicas tratam de assegurar a confiabilidade do estudo, ou seja, verificam questões como a experiência dos centros de pesquisa executores e as condições no sentido de garantir a geração de resultados rastreáveis e confiáveis, além das ações a serem adotadas para monitorar a execução do estudo.
Para avaliação das propostas de estudo, e eventual registro de vacinas contra a Covid-19, foi instituído um comitê de especialistas composto por 10 profissionais rotativos. Dessa forma, as responsabilidades são compartilhadas e as decisões podem ser tomadas com mais segurança. Essa equipe multidisciplinar – formada por farmacêuticos, médicos, biólogos e estatísticos – avalia os quatro aspectos de forma minuciosa e, ao mesmo tempo, célere. Para se ter uma ideia da qualidade do corpo técnico desse comitê, todos os profissionais que fazem essas análises têm, no mínimo, 10 anos de experiência na avaliação de protocolos de estudo e registro de vacinas.
Assim que o estudo é anuído, ou seja, após receber a autorização para desenvolvimento, a Anvisa monitora seu progresso e os resultados gerados. Isso é feito a partir de trocas de informações e comunicação frequente com os pesquisadores e patrocinadores do estudo. Esse acompanhamento permite, por exemplo, que a Anvisa interrompa um estudo em casos de eventos adversos graves. E o trabalho da Anvisa não para por aí. Mesmo depois do registro de uma vacina, a área de farmacovigilância da Agência recebe e trata os dados relacionados ao desempenho da vacina.
Importante lembrar que, quando o desenvolvimento clínico de uma vacina é totalmente conduzido fora do Brasil, como é o caso da vacina russa, a exigência de anuência prévia aos estudos clínicos não faz sentido. Porém, é necessário o cumprimento dos devidos procedimentos para registro da vacina. Nesse sentido, a Anvisa está em tratativas e já realizou reuniões com membros do governo do estado do Paraná e do Instituto de Tecnologia do Paraná (Tecpar) sobre o processo de registro da vacina desenvolvida pela Rússia. Essas reuniões são de caráter preliminar, antecipando possíveis demandas futuras.
Fonte: Site da Anvisa